
2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
核糖核酸酶A (RNase A) 是一种核糖核酸内切酶,可以水解核苷上5’-核糖与相邻的嘧啶核苷3’-核糖上的磷酸基团之间的磷酸二酯键,产生的2’,3’-环磷酸可水解为相应的3’-核苷磷酸盐。因而可在C和U核苷酸残基位置特异性地降解单链RNA。RNase A的反应条件极广,且极难失活。RNase A作用于单链RNA时,提升较高效率。
-1.jpg)
RNase是一类普遍存在的酶,真核生物、古细菌和细菌中至少存在21种类型的RNA酶,在基因表达和调控、基因组复制和维持、宿主防御、应激反应、病毒感染等生物学过程中发挥重要作用。其中,RNase A是使用较为广泛的一种核糖核酸酶。
你是否 “理所当然”地认为核糖核酸酶A的功能就是降解核糖核酸(RNA)。事实上,随着研究的深入,我们发现其不仅能降解RNA,而且可以精准地在特定位点切割RNA产生功能性非编码RNA,甚至具有“非酶”功能!在RNase A的探索应用道路中,科研人员从未停止过步伐,不妨来看看以下这些应用场景吧~
RNase A在端粒免疫荧光原位杂交实验中,可降低核仁着色对端粒图像清晰度的影响。
方法:分别将0.1、0.2、0.4 mg/mL的核糖核酸酶A(RNase A)与待检标本于37℃消化过夜,然后进行端粒原位杂交实验。
结果表明:0.4 mg/mL RNase A可以消除HepG2细胞端粒原位杂交时的非特异结合,使用HeLa、293T和U2OS细胞也有同样效果。因此,在进行端粒原位杂交实验时,用0.4 mg/mL RNase A消化核仁可减少探针的非特异结合,提高端粒图像的清晰度[1]。
RNase是一种分泌酶,主要功能是降解核酸RNA,对宿主防御至关重要。实验室常用的RNase是牛胰RNase A,人源中与之对应的是RNase 5(血管生成素 [ANG]),可以通过与表皮生长因子受体(EGFR)直接关联,独立于其催化活性从而触发致癌转化。
研究人员在探索细胞外RNA如何影响细胞过程中,发现牛胰核糖核酸酶可以激活多种人类癌细胞中的酪氨酸磷酸化的信号级联反应,且以EGFR激酶依赖性方式触发EGFR下游信号传导。
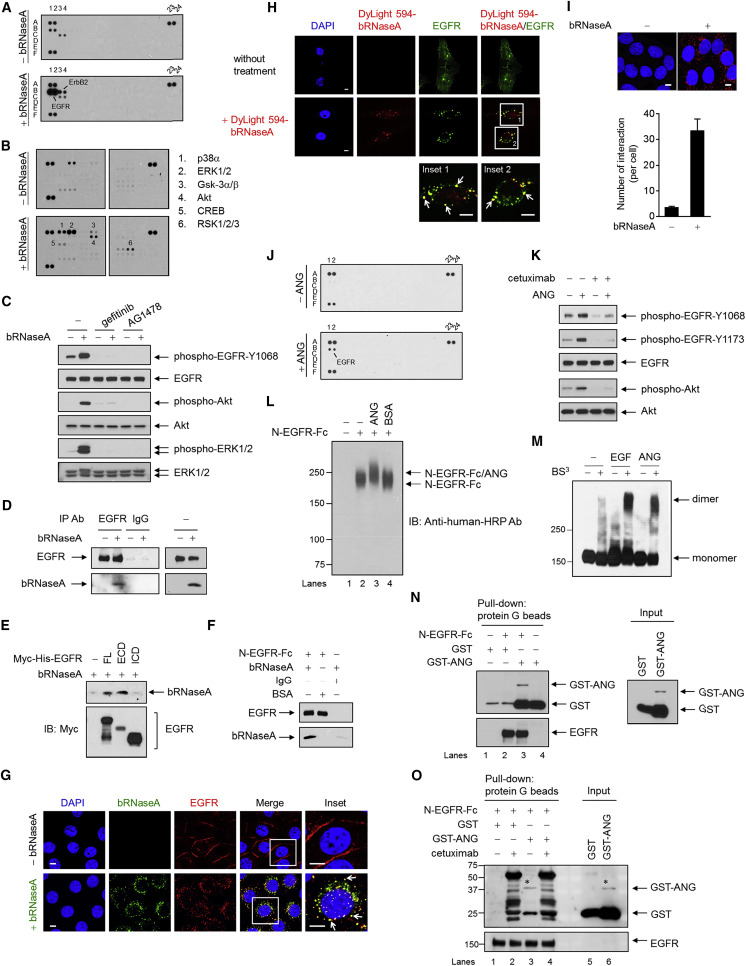
图1 牛胰RNase A和ANG与EGFR相关并触发EGFR信号传导
总的来说,这些结果表明牛胰RNase A与EGFR相互关联,诱导EGFR内化和下游信号通路,并揭示牛胰RNase A作为EGFR配体来传递细胞内EGFR信号传导[2]。
核糖核酸酶A是一种细胞毒性蛋白,能够切断细胞的RNA从而使细胞凋亡。研究人员利用4-硝基苯基(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苄基)碳酸酯(NBC)对RNase A进行修饰,发现NBC修饰能有效抑制RNase A的活性,形成RNase A前药—RNase A-NBC。
由于癌细胞中高表达H2O2,所以高浓度的H2O2能激活被运载到细胞中的RNase A前药的活性。激活的RNase A一方面能切断癌细胞中的RNA,促使细胞凋亡,另一方面末端修饰荧光基团的底物RNA链在RNase A的催化下会被切断,荧光增强,这可用于癌细胞的选择性响应。通过荧光增强动力学和毒性动力学实验,能清楚地观察到RNase A前药在细胞内的激活响应过程。最后通过对RNase A的可逆修饰进行深入研究,制备基于不同脂质的纳米复合物,成功合成了含有RNase A前药和RNA底物的纳米复合物,并对RNase A前药性能以及在细胞内外的激活动力学进行了探索[3]。
↑ 点击图片了解产品详情 ↑
金普诺安自主研发生产的核糖核酸酶A(Ribonuclease A/RNase A)是经过蛋白质工程技术改造的源于牛胰腺(bovine pancreas)的非特异性核糖核酸内切酶,经过酵母表达、纯化获得。它不含有原核生物表达的细菌内毒素。
结语:
核糖核酸酶A(RNase A)作为一种重要的酶,具有广泛的生物学功能和潜在应用价值。通过深入研究其结构和功能,我们可以更好地理解其在细胞生理和疾病发展中的作用机制。
文献引用
[1]于芳,金蕊,黄君健. 核糖核酸酶A在端粒免疫荧光原位杂交实验中的应用[J]. 生物技术通讯,2017,28(5):681-684. DOI:10.3969/j.issn.1009-0002.2017.05.022.
[2] WANG, YING-NAI, LEE, HENG-HUAN, CHOU, CHAO-KAI, et al. Angiogenin/Ribonuclease 5 Is an EGFR Ligand and a Serum Biomarker for Erlotinib Sensitivity in Pancreatic Cancer[J]. Cancer Cell,2018,33(4):752-769. DOI:10.1016/j.ccell.2018.02.012.
[3]孟江南,林珉杰,邢航.核糖核酸酶A的可逆修饰及其纳米复合物对过氧化氢响应的研究[J]. 2019.
——文中部分插图来源摄图网,已授权。